


Rationale Diagnostik und Therapie
Borrelieninfektionen sind die häufigsten zeckenübertragenen Infektionen überhaupt. Etwa 4% aller Zeckenstiche verursachen eine derartige Infektion. In aller Regel wird diese Infektion zunächst durch ein Erythema migrans an der Stichstelle sichtbar, bevor es zu einer Erregergeneralisation kommt.
Durch adäquate Zeckenentfernung lassen sich viele Infektionen verhindern.
Die Klinik der Borrelieninfektion ist äußerst vielfältig, im Spätstadium ist eine Kombination von Allgemeinsymptomen wie Nachtschweiß und Abgeschlagenheit mit Symptomen am Bewegnungsapparat (Myalgien, Arthralgien) typisch.
Die Diagnostik stützt sich neben der klinischen Symptomatik vor allem auf serologische Testverfahren, deren Durchführung und Interpretation inzwischen standardisiert sind.
Die Borreliose kann in jedem Stadium erfolgreich therapiert werden. Bei der frischen Infektion genügt eine orale Therapie, im chronischen Stadium sind intravenöse Therapieregime notwendig.
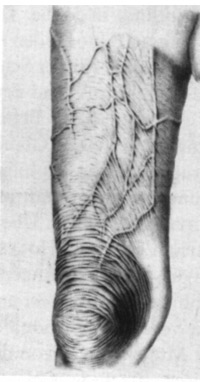
Einige klinische Manifestationen der Lyme-Borreliose sind schon seit mehr als hundert Jahren bekannt. Bereits 1883 wurde von BUCHWALD eine "diffuse idiopathische Hautatrophie" beschrieben, POSPELOW (1886) sprach von „atrophie idiopathique de la peau", JUDASSOHN (1891) von "atrophia maculosa cutis" und PICK 1894 von "Erythromyelie". Alle diese Krankheitsbilder erkennen wir heute als Varianten der zum Formenkreis der Borreliose zählenden Acrodermatitis chronica atrophicans (ACA).
Auch das Erythema migrans wurde bereits 1910 beschrieben, die akute neurologische Verlaufsform 1941 von Garin und Bujadoux. Erst mit der „Neuentdeckung“ der Borreliose 1975 in Lyme/Connecticut wurde aber das Krankheitsbild allmählich als Entität begriffen und mit der Entdeckung des Erregers durch Burgdorfer 1982 der Grundstock zur Diagnostik gelegt.
1 Von POSPELOW stammt übrigens die immer wieder zitierte Beschreibung der "zigarettenpapierartigen Fältelung der Haut" bei der Acrodermatitis chronica atrophicans
Borrelien werden in erster Linie von Schild-Zecken (bei uns Ixodes ricinus, der Holzbock) zwischen verschiedenen Mäusegenerationen weitergegeben.
Hier spielt eine Besonderheit des Mäuse-Immunsystems eine Rolle: Die Maus erkrankt an der Borrelieninfektion nicht, sie lässt sogar eine lebenslängliche Bakteriämie zu. Dadurch können die im Mäuseblut zirkulierenden Borrelien jederzeit von Zecken wieder aufgenommen werden.
Die Zecke ist nur zu etwa 1% bereits transovariell mit Borrelien infiziert. Das erste Entwicklungsstadium, die Larve, nimmt bei ihrer ersten Blutmahlzeit Borrelien aus Mäusen auf. Danach häutet sie sich zur Nymphe. Diese Nymphen sind bereits zu 15-25% mit Borrelien infiziert. Nach einer weiteren Blutmahlzeit häutet diese sich erneut und wird zum adulten Tier. Nur die adulten Weibchen brauchen dann vor der Eiablage eine weitere Blutmahlzeit.
Da also Zecken in ihrem Lebenszyklus zwei oder drei Blutmahlzeiten benötigen, kann der Erreger immer wieder aufgenommen und weitergegeben werden.

Der Mensch spielt eigentlich im natürlichen Zyklus der Borrelien keine Rolle, aus Sicht des Erregers ist er sogar eine epidemiologische Sackgasse. Immunologisch unterscheidet sich der Mensch von der Maus: Er toleriert den Erreger nicht, sondern attackiert diesen. Der Preis dafür ist, dass der Mensch klinisch erkrankt. Andererseits wird eine Bakteriämie beim Menschen nur kurze Zeit möglich sein, so dass der Erreger nicht wieder aus peripherem Blut aufgenommen und weitergegeben werden kann. Daher ist eine Borreliose beim Menschen auch nicht durch Blutkontakte oder sexuell zu übertragen.
Borrelien werden ausschließlich durch Zeckenstich übertragen. Der Erreger befindet sich im Mitteldarm der Zecke. Ebenso wie die Zecke selbst müssen die Borrelien lange nahrungsfreie Intervalle überstehen und können in dieser Zeit ihren Stoffwechsel drosseln. Nach Beginn der Blutmahlzeit steht Nahrungssubstrat zur Verfügung, nun beginnen die Borrelien ihren Stoffwechsel zu steigern und wandern etwa nach 14 Stunden aktiv in die Speicheldrüsen der Zecke, von dort aus können sie mit Speichelsekret in die Stichwunde übertragen werden. Dies geschieht in der Regel erst nach mindestens 14 Stunden. Wenn man eine Zecke in dieser Zeit entfernt, kommt es also in der Regel nicht zur Infektion, wenn die Zecke nicht bei der Entfernung gequetscht wird und so auch Darminhalt in die Wunde gelangt.
Merke: Zecke bei der Entfernung niemals quetschen! Ungeeignet sind daher Pinzetten, Zeckenzangen und ähnliche Instrumente.
Besser geeignet ist ein Skalpell der Form 11, dessen fein ausgezogene Spitze man in den Spalt zwischen Haut und Zeckenkörper schiebt. Dann wird die Zecke durch Hebelwirkung nach oben gedrückt und herausgezogen (siehe Bild)
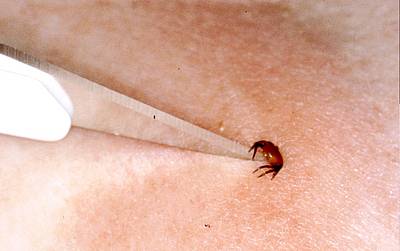
Im Mittel sind etwa 15% der Zecken, die an Menschen saugen, mit Borrelien infiziert (Oehme et. Al, ##). Interessanterweise waren 80% dieser Zecken Nymphen, also das mittlere Entwicklungsstadium. Diese Nymphen sind nur etwa 1,5-2,5mm groß. Warum adulte Zecken eher selten an Menschen gefunden werden, ist unbekannt. Die Untersuchungen von Oehme haben gezeigt, dass es bei borrelienhaltigen Zecken in jedem vierten Fall zur Übertragung des Erregers kam. Man kann also folgende Rechnung aufmachen: 15% der Zecken enthalten Borrelien, aber nur 4% aller Zeckenstiche führen zu einer Borrelieninfektion.
Angesichts dieser Zahlen lehnen wir (Landesarbeitsgruppe zeckenübertragene Erkrankungen Baden-Württemberg, Anm. des Verf.) eine generelle antibiotische Prophylaxe nach Zeckenstich ab und empfehlen eine Untersuchung der Zecke mittels PCR auf Borrelien. Nur bei positivem Nachweis halten wir eine antibiotische Prophylaxe für gerechtfertigt, da sonst 96% aller Patienten unnötig behandelt würden.
Prospektive eigene Untersuchungen haben gezeigt, dass in Endemiegebieten etwa 500 pro 100 000 Einwohner jährlich an einer Borreliose neu erkranken (Hassler, HabilSchr.). Diese Erkrankungsrate konnte durch adäquate Zeckenentfernung auf 85 pro 100 000 gesenkt werden.
Im Bundesgebiet kommt es nach Schätzungen aufgrund derartiger prospektiver Untersuchungen zu mehreren zehntausend Neuerkrankungen pro Jahr. Diese Zahl ließe sich durch adäquate Zeckenentfernung erheblich senken.
Nach Übertragung des Erregers beim Zeckenstich vermehren sich die Borrelien in der Haut und wandern aktiv von der Stichstelle nach peripher mit einer Geschwindigkeit von 3-6mm/Tag. Die Generationszeit beträgt bei Borrelien 12-36 Stunden, im Mittel 24 Stunden. Die Vermehrung des Erregers geschieht also sehr langsam, so dass in der Regel erst nach 7-14 Tagen die Zahl der Erreger so groß ist, dass eine erkennbare Immunreaktion einsetzt. Dann strömen Lymphozyten und Plasmazellen in das infizierte Gebiet ein und verursachen sie für uns sichtbare Verfärbung der Haut, das Erythema migrans.
Die „Siebentageregel“
Alles, was vor dem siebten Tag an der Stichstelle sichtbar wird, gehört zur „primären Stichreaktion“. Diese wird durch mechanische Irritationen, etwa bei der Zeckenentfernung, oder durch Fremdkörperreaktionen auf Zeckenteile oder Zeckenspeichel ausgelöst. Ein Erythema migrans wird frühestens nach sieben Tagen sichtbar.
Bild: Das Erythema migrans ist die sichtbar werdende zelluläre Immunreaktion (hier etwa 21 Tage nach Zeckenstich)
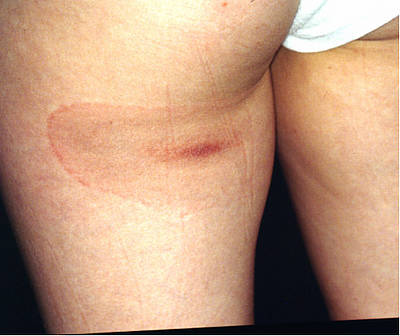
Ein Erythema migrans ist eine Blickdiagnose! Wir finden niemals ekzematöse Veränderungen, die Epidermis bleibt intakt.
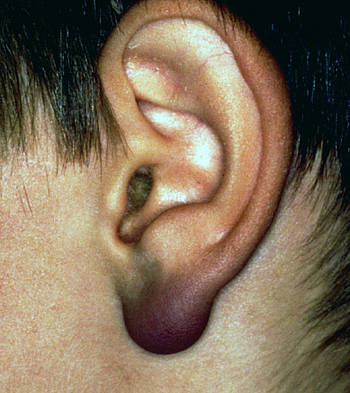
Ein Sonderfall des Erythema migrans ist das Borrelienlymphozytom (BL). Manchmal sehen wir im Zentrum eines Erythema migrans eine etwas dichtere Zellinfiltration, die ein Lymphozytom repräsentiert. Dieses kann auch solitär auftreten, vor allem bei Kindern am Ohr. Der Grund ist einfach darin zu sehen, dass die Borrelien bei ihrer peripheren Ausbreitung am Ohr auf Grenzen stoßen, so dass sich ein deutlicheres lokales Infiltrat bilden kann. Pathophysiologisch und histologisch sind die Übergänge von EM zu BL fließend. Wir haben allerdings beobachtet, dass ein solitäres Lymphozytom häufig im Rahmen von Re-Infektionen auftreten kann. In diesen Fällen setzt die Immunreaktion etwas früher und heftiger ein als bei der Erstinfektion, so dass sich ein dichteres Infiltrat von Abwehrzellen auf kleinem Raum bildet.
Sowohl beim Erythema migrans wie auch beim Lymphozytom finden wir in der Regel noch keine serologisch nachweisbaren Antikörper. Die Therapie darf daher niemals vom Antikörperstatus abhängig gemacht werden!
Bei der Wanderung durch die Haut treffen die Borrelien früher oder später auf Blutgefäße, deren Wände sie durchwandern. Dann beginnt die Bakteriämie im Sinne einer Erregergeneralisation. Diese kann völlig subklinisch verlaufen aber auch von heftigen Allgemeinsymptomen wie Abgeschlagenheit, Grippegefühl, Nachtschweiß und Palpitationen begleitet sein. Die Zahl der Erreger und die Heftigkeit der Immunreaktion bestimmt die Intensität der klinischen Symptome.
Nun setzt die Immunreaktion ein, Antikörper werden gebildet, Makrophagen bekämpfen die Borrelien, so dass die Phase der klinisch erkennbaren Bakteriämie meist nur wenige Tage dauert. Trotzdem kann die Erregerstreuung bereits vorher erfolgt sein und zu Organbeteiligungen führen.
Kommt es zur Liquorinvasion, tritt eine lymphozytäre Meningitis auf (etwa 3-5% aller Fälle), das Vollbild ist die Kombination der Meningitis mit Neuritiden peripherer Nerven („Bannwarth-Syndrom“.
Kardiale Beteiligungen können zu Reizleitungsstörungen, intermittierenden Tachyarrhythmien und zur Myocarditis führen. Selten kann diese protrahiert verlaufen und eine Kardiomyopathie auslösen.
Borrelien haben eine besondere Affinität zur kollagenen Faser. In diesen Fasern können sie den Angriffen des Immunsystems entgehen und eine persistente Infektion bedingen. An diesen „immunologisch privilegierten Orten“ können die Borrelien lange überdauern und nach Monaten bis Jahren Symptome des Spätstadiums initiieren. In der chronischen Phase sind vor allem Gewebe des Stützapparates, also Sehnen, Knorpel und Knochen betroffen. Daher leiden die Patienten oft unter Arthralgien und Myalgien, Schmerzen in den Sehnenansätzen und vermehrter Periostempfindlichkeit.
Die eigentliche Lyme-Arthritis ist nicht selten. Sie betrifft meist die größeren Gelenke, vor allem die stärker mechanisch belasteten wie Knie- und Sprunggelenke. Oft treten massive Ergüsse auf, manchmal so heftig, dass es zur Ruptur von Bakercysten kommt. Oft wechseln die betroffenen Gelenke in recht kurzen Intervallen.
Auch im chronischen Stadium kommt es in Phasen der Krankheitsaktivität recht regelhaft zu begleitenden Allgemeinsymptomen: Die Patienten fühlen sich extrem abgeschlagen und müde, schwitzen nachts oft heftig und klagen über Palpitationen. Derartige Schübe werden oft ein bis viermal pro Monat berichtet.
Bei einem Teil der Patienten entsteht nach jahrelangem Verlauf eine sensible Polyneuropathie, die durch eine axonale Degeneration peripherer Nerven ausgelöst wird. Motorische Ausfälle sind dagegen extrem selten.
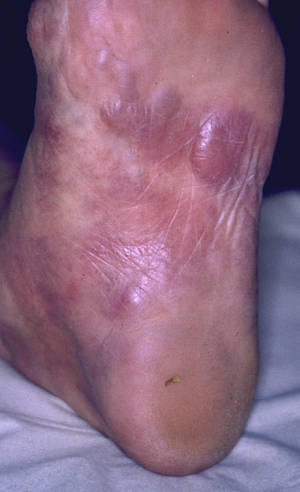
Schließlich können sich Borrelien, bedingt durch ihr Temperaturoptimum von 32-34°C, an den kühleren Akren aufkonzentrieren. Hier zeigt sich dann bisweilen eine Acrodermatitis chronica atrophicans (ACA) mit blauroten Verfärbungen der Haut. Aus diesen Arealen lassen sich Borrelien problemlos anzüchten, was die Erregerpersistenz bei der chronischen Borreliose beweist.
Aufgrund einer Arbeit von van Dam (##) wird immer wieder angegeben, dass die verschiedenen Borrelienarten unterschiedliche Krankheitsbilder auslösen. So soll Borrelia afzelii besonders oft Hautbeteiligungen, insbesondere die ACA auslösen, B. garinii soll besondere Affinität zum Nervengewebe haben, B. burgdorferi am häufigsten für die Lyme-Arthritis verantwortlich sein. Diese Annnahme muss hinterfragt werden, weil die Verteilung der Borrelienarten in den Benelux-Staaten eine andere ist als beispielsweise in Süddeutschland. Führende Art in Holland ist B. garinii, in unseren Untersuchungen in Süddeutschland fanden wir mit 44% am häufigsten B. afzelii. Zumindest in Einzelfällen konnten alle Arten bei allen Krankheitsbildern nachgewiesen werden.
Die Diagnostik bei Borrelieninfektionen ruht auf mehreren Säulen: Klinik, Serologie und Erregerdirektnachweis.
Bei der frischen Infektion ist ausschließlich das klinische Bild entscheidend. Ein Erythema migrans ist eine Blickdiagnose und muss grundsätzlich behandelt werden, auch wenn die Serologie noch negativ ist.
Bei der bereits generalisierten Infektion wird man in der Regel schon serologisch nachweisbare IgM-Antikörper erwarten können, im Spätstadium sind IgG-Antikörper zwingend zu erwarten. Auch während akuter Krankheitsschübe im Spätstadium muss das IgM nicht wieder positiv werden, oft sind nur IgG-Antikörper nachweisbar.
Daher bestimmt das klinische Bild die Vorgehensweise.
► Ein Erythema migrans wird grundsätzlich ohne Serologie behandelt, ein Erregernachweis mittels PCR oder Kultur aus Hautbiopsien wäre möglich, ist aber in der Regel nicht notwendig.
► Bei Verdacht auf Borrelieninfektion in der Generalisationsphase ist die Serologie oft hilfreich, kann aber zu Beginn noch negativ sein. Daher ggf. Wiederholung nach zwei bis drei Wochen.
► Bei Verdacht auf Neuroborreliose (mit ZNS-Beteiligung) ist eine Liquorpunktion mit Nachweis autochtoner Antikörperbildung beweisend.
► Bei chronischen Infektionen mit Symptomen des Spätstadiums, vor allem bei Gelenkbeteiligungen, sind zwingend IgG-Antikörper notwendig, um die Diagnose einer Borreliose zu rechtfertigen, seronegative Borreliosen im Spätstadium gibt es nicht. Der Erregernachweis gelingt dagegen nur in Ausnahmefällen, am ehesten aus Synoviabiopsien.
► Bei der Acrodermatitis ist ein Erregernachweis mittels PCR oder Kultur problemlos aus Hautbiopsien möglich. Diese Technik erlaubt bei der ACA auch eine Therapiekontrolle.
Heute wird generell ein zweistufiges Testverfahren eingesetzt. Zunächst wird aus technischen Gründen ein Suchtest vorgeschaltet (IFT oder Elisa-Format), der sich weitgehend automatisiert durchführen lässt. Erhält man mit diesem Test ein positives Ergebnis, wird die Spezifität der Antikörper mittels Westernblot (=Immunoblot) bestätigt. So können unspezifische Kreuzreaktionen der Suchteste und damit falsch-positive Ergebnisse erkannt werden.
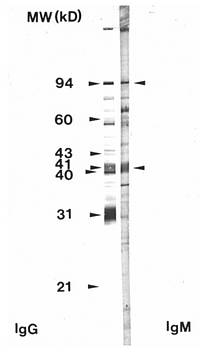
Das Prinzip des Westernblot funktioniert so: Im Labor kultivierte Borrelien werden in ihre Einzelproteine zerlegt, diese werden elektrophoretisch aus einem Nitrozellulosestreifen aufgetrennt und so nach Molekulargewichten sortiert. Dann wird dieser Streifen mit Patientenserum inkubiert. Wenn Antikörper gegen die einzelnen Proteine vorliegen, binden diese und werden über eine Farbreaktion sichtbar gemacht. Das entstehende Muster ähnelt einem Barcode und zeigt sofort, welche der Borrelienproteine vom Patientenserum „erkannt“ werden. Einige der Proteine sind völlig unspezifisch und damit stark kreuzreagierend (etwa 41kD Flagellin, ein in der Bakterienwelt bei allen flagellentragenden Bakterien verbreitetes Protein). Andere, wie 31kD-OSP A und das 94 kD-Protein, sind hochspezifisch. Das Gesamtmuster wird dann nach international festgelegten Kriterien interpretiert.
Da alle Borrelienarten stark kreuzreagierend sind, kann man prinzipiell mit jeder Art einen Westernblot durchführen, im Allgemeinen werden aber zur Diagnostik B. afzelii-Stämme eingesetzt. Mit diesen Tests können aber dennoch auch B. garinii-Infektionen erkannt werden.
Abb: Westernblot mit Nachweis multipler Banden (starke 31-kD-IgG-Bande, auch 41 kD, 58 kD und 94 kD sind im IgG positiv) bei einem Patienten mit Lyme-Arthritis
Das Prinzip des LTT ist eigentlich bestechend: Man konfrontiert lebende Lymphozyten eines Patienten mit einem Antigen und überprüft, ob diese darauf reagieren, indem man die Stoffwechselaktivität über den Einbau von 3H-Thymidin misst.
Leider unterliegt dieser Test starken Schwankungen und liefert oft falsch-positive Ergebnisse. Die derzeit auf dem Markt angebotenen LTT-Teste sind nicht hinreichend validiert und daher derzeit nicht zu empfehlen.
Die Therapie der Borreliose ist ebenso wie die Diagnostik stadienabhängig. Die frischen Infektionen (Erythema migrans und Lymphozytome) werden beim Erwachsenen mit Doxycyclin 3x100 mg täglich über 20 Tage therapiert. Alternativen sind: Amoxicillin 3x750mg bis 4x1g/20 Tage; Cefuroximaxetil 2-3x500 mg/20 Tage oder Azithromycin 500 mg/10 Tage.
Erythromycin hat in allen Studien deutlich schlechter abgeschnitten und kann nicht mehr empfohlen werden, auch Roxithromycin wird nicht empfohlen.
Bei Kindern und Jugendlichen wird mit Amoxicillin oder Cefuroximaxetil therapiert (gewichtsadaptiert, 20 Tage), da Doxycyclin bei Kindern nicht eingesetzt werden kann. Alternative ist Azithromycin über mindestens 10 Tage.
Borrelien-Infektionen im Stadium der Generalisation mit Allgemeinsymptomatik können prinzipiell genauso wie frühe Infektionen behandelt werden. Bei ZNS-Beteiligung sollte eine intravenöse Therapie erfolgen (beim Erwachsenen Cefotaxim 2x3g tgl/15 Tage oder Ceftriaxon 2g tgl/ 15 Tage, bei Kindern gewichtsadaptiert). Bei Cephalosporinallergie bleiben nur Penicilline oder Imipenem.
Im chronischen Stadium sind orale Therapieversuche zwecklos, nur die intravenösen Therapieregime (s.o.) sind gesichert wirksam.
Phase 1: Lokalinfektion („Stadium 1“)
(Erythema migrans und Borrelienlymphozytom)
Bei Erwachsenen: Doxycyclin 2-3x100 mg/20 Tage
Alternativen: Amoxicillin 3x750-4x1000 mg/20 Tage
Cefuroxim-Axetil 2-3x500 mg/20Tage
Azithromycin 500 mg/10 Tage
Bei Kindern: Amoxicillin (3-4xtgl 15mg/kgKG),
Cefuroxim-Axetil (2-3x tgl 6mg/kgKG),
Azithromycin (1xtgl 6mg/kgKG)
Bei Schwangeren: Amoxicillin, Cefuroxim-Axetil (wie oben)
Phase 2 (Bakteriaemiephase)
Siehe oben, alternativ auch i.v. Therapie mit Cefotaxim oder Ceftriaxon
Bei ZNS-Beteiligung (Bannwarth-Syndrom): iv Cephalosporine
Phase 3 (chronisches Stadium)
Cefotaxim 2x3 bis 2x4 g/15-21 Tage i.v.
Ceftriaxon 2-4g/14-21 Tage i.v.
Für eine prolongierte Therapie über mehr als 20 Tage liegt kein Beleg für einen Benefit vor, die Nebenwirkungen steigen aber erheblich an.
Für eine orale Therapie mit Doxycyclin im chronischen Stadium fehlen Belege der Wirksamkeit.
Nach Therapie eines Erythema migrans wird routinemäßig nach drei Monaten einmalig die Serologie kontrolliert. Wenn es dann nicht zur IgG-Serokonversion gekommen ist, gilt die Erkrankung als ausgeheilt. Reste von IgM-Antikörpern können noch längere Zeit nachweisbar sein, dies ist nicht beunruhigend.
Nach Therapie einer chronischen Borreliose werden im Allgemeinen mindestens vier serologische und klinische Kontrollen in sechsmonatigen Abständen vorgenommen. Dann kann man in der Regel ein langsames Verschwinden der spezifischen Immunantwort erkennen. Die Klinik hat aber eindeutig Vorrang in der Beurteilung des Therapieerfolges: Meist verschwinden als erstes die Allgemeinsymptome wie Abgeschlagenheit und Nachtschweiß, Gelenkschmerzen bessern sich meist zögernd über Wochen und Monate, Neuropathien hinterlassen oft eine Defektheilung.
Da bei Borrelien keine Resistenzen gegen die üblicherweise eingesetzten Antibiotika existieren, reduziert jede Therapie die Zahl der Borrelien um einige Größenordnungen. Man kann also immer zumindest mit einer vorübergehenden Besserung rechnen. Rezidive kündigen sich frühestens nach 10-12 Wochen durch ein Wiederauftreten der ursprünglichen Symptome an. Ein völlig ausbleibender Therapieerfolg sollte daher immer Anlass sein, die Diagnose nochmals kritisch zu hinterfragen.
Generell gilt: Borreliosen sind in jedem Stadium heilbar.
In jüngster Zeit wurde eine Studie von Klempner (##) stark diskutiert. Klempner fand, dass im chronischen Stadium durch wiederholte intravenöse Therapien keine Verbesserung der Symptomatik erreicht werden kann. Diese Studie wird immer wieder als Beleg angeführt, dass es keinen Sinn mache, nochmals intravenös zu behandeln, wenn die klinische Symptomatik persistiert. Da in Klempners Studie aber mehr als 50% der Patienten eine sogenannte „seronegative“ Borreliose hatten, hat diese Untersuchung absolut keine Aussagekraft, da es seronegative Borreliosen im Spätstadium schlicht nicht gibt.
Eigene Zahlen von mehr als 1500 Patienten mit chronischer Borreliose zeigen folgende Ergebnisse: 82% waren mit einem Therapiezyklus dauerhaft geheilt, bei 18 % war ein zweiter, bei 8% ein dritter und bei 3% ein vierter Zyklus notwendig. Nur bei drei Patienten mit Allergien gegen Penicilline und Cephalosporine war keine kurative Therapie möglich.
Baradaran-Dilmaghani R, G. Stanek
In vitro susceptibility of thirty Borrelia strains from various sources against eight antimicrobial chemotherapeutics
Infection 14 (1996) 60-63
Berger BW
Erythema migrans.
Clin Dermatol, (1993 Jul-Sep) 11 (3) 359-62.
Bergler-Klein J, Glogar D, Stanek G:
Clinical outcome of Borrelia burgdorferi related dilated cardiomyopathy after antibiotic treatment.
Lancet 1992; 340: 317–318
Breier F; Kunz G; Klade H; Stanek G; Aberer E
Erythema migrans: three weeks treatment for prevention of late Lyme borreliosis.
Infection. 1996 Jan-Feb; 24(1): 69-72
Dattwyler-RJ; Halperin-JJ; Volkman-DJ; Luft-BJ Treatment of late Lyme borreliosis--randomised comparison of ceftriaxone and penicillin. Lancet. 1988 May 28; 1(8596): 1191-4
Dattwyler-RJ; Volkman-DJ; Conaty-SM; Platkin-SP; Luft-BJ
Amoxycillin plus probenecid versus doxycycline for treatment of erythema migrans borreliosis.
Lancet. 1990 Dec 8; 336(8728): 1404-6
Dattwyler RJ, Luft BJ, Kunkel MJ, Finkel MF, Wormser GP, Rush TJ, Grunwaldt E, Agger WA, Franklin M, Oswald D, Cockey L, Maladorno
Ceftriaxone compared with doxycycline for the treatment of acute disseminated Lyme disease
N Engl J Med 1997 Jul 31;337(5):289-94
Dever LL, Jorgensen JH, Barbour AG:
Comparative in vitro activities of clarithromycin, azithromycin, and erythromycin against Borrelia burgdorferi.
Antimicrob. Agents Chemother. 37(8) (1993) 1704-6
Donta ST
Tetracycline Therapy for chronic Lyme disease
Clin Infect Dis 25 (1997) Suppl. 1 (52-56)
Dotevall L, Alestig K, Hanner P, Norkrans G, Hagberg L.
The use of doxycycline in nervous system Borrelia burgdorferi infection.
Scand J Infect Dis Suppl 1988; 53:74 9.
Dotevall L, Hagberg L.
Successful oral doxycycline treatment of Lyme disease associated facial palsy and meningitis.
Clin Infect Dis 1999; 28:569 74
Gasser R, Reisinger E, Sedaj B, Horvarth R, Seinost G, Keplinger A, Wendelin I, Klein W:
Oral treatment of late Lyme Borreliosis with a combination of Roxithromycine and Co-Trimoxazole – a pilot study on 18 patients.
Acta Med Austriaca 1996;23(3):99-101
Hansen K et al.
Roxithromycin in Lyme Borreliosis: discrepant results of an in vitro and in vivo animal susceptibility study and a clinical trial in patients with erythema migrans
Acta Derm Venereol 72 (1992) 297-300
D. Hassler, L. Zöller, M..Haude, H.D. Hufnagel und H.G. Sonntag:
Lyme-Borreliose in einem europäischen Endemiegebiet. Antikörperprävalenz und klinisches Spektrum.
Dtsch Med Wochenschr 117 (1992) 767-774
Hassler D; Zöller L; Haude M; Hufnagel HD; Heinrich F; Sonntag HG
Cefotaxime versus penicillin in the late stage of Lyme disease prospective, randomized therapeutic study.
Infection, (1990 Jan Feb) 18 (1) 16 20
Hassler D, Riedel K, Zorn J, Preac-Mursic :
Pulsed high dose cefotaxime therapy in refractory Lyme borreliosis.
Lancet 338 (1991) 193 (Letter)
Hassler D
Langzeitbeobachtungen zum Krankheitsbild der Lyme-Borreliose in einem Endemiegebiet: Daten zur Vektorökologie, Epidemiologie, Serologie und Klinik, Therapie und Therapiekontrolle.
Habilitationsschrift, Heidelberg 1998 (unveröffentlicht)
Hassler D, Schnauffer M, Ehrfeld H, Müller E.
Disappearance of specific immune response after successful therapy of chronic Lyme borreliosis.
Int J Med Microbiol. 2004 Apr;293 Suppl 37:161-4.
Huppertz HI Karch H Suschke HJ Doring E Ganser G Thon A Bentas W
LYME ARTHRITIS IN EUROPEAN CHILDREN AND ADOLESCENTS. THE PEDIATRIC RHEUMATOLOGY COLLABORATIVE GROUP.
Arthritis Rheum 1995 Mar;38(3):361-8
Johnson RC:
Isolation techniques for spirochetes and their sensitivity to antibiotics in vitro and in vivo.
Rev. Infect. Dis. 1989 Sep-Oct; 11 Suppl 6: 1505-10
Karlsson M Hammers-Berggren S Lindquist L Stiernstedt G Svenungsson B
Comparison of intravenous Penicillin G and oral Doxycycline for treatment of Lyme Neuroborreliosis
Neurology 1994 Jul;44(7):1203-7
Klempner MS et al.
Two controlled trials of antibiotic treatment in patients with persistent symptoms and a history of Lyme disease.
N Engl J Med 345 (2001) 85-92
Kohlhepp-W; Oschmann-P; Mertens-HG Treatment of Lyme borreliosis. Randomized comparison of doxycycline and penicillin G. J-Neurol. 1989 Dec; 236(8): 464-9
Liu NY, Dinerman H, Levin RE:
Randomized trial of doxycycline vs. amoxicillin/probenecid for the treatment of Lyme arthritis: treatment of non responders with iv penicillin or ceftriaxone.
Arthritis Rheum. 32 (1989) 46
Luft BJ, Dattwyler RJ, Johnson RC, Luger SW, Bosler EM, Rahn DW, Masters EJ, Grunwaldt E, Ggdil SD
Azithromycin compared with Amoxicillin in the treatment of erythema migrans. A doble blind, randomized, controlled trial.
Ann Intern Med 124 (1996) 785-91
Luger S W; Paparone P; Wormser G P; Nadelman R B; Grunwaldt E; Gomez G; Wisniewski M; Collins J J.
Comparison of cefuroxime axetil and doxycycline in treatment of patients with early Lyme disease associated with erythema migrans.
Antimicrob Agents Chemother, (1995 Mar) 39 (3) 661-7.
Maiwald M, Oehme R, March O, Petney TN, Kimmig P, Naser K, Zappe HA, Hassler D, von Knebel Doeberitz M
Transmission risk of Borrelia burgdorferi sensu lato from Ixodes ricinus ticks to humans in southwest Germany
Epidemiol Infect 1998 Aug;121(1):103-8
Mülleger RR, Millner MM, Stanek G, Spork KD:
Penicillin G sodium and Ceftriaxone in the treatment of neuroborreliosis in children - a prospective study.
Infection 19 (1991) 279-83
Nadelman RB, Arlin Z, Wormser GP:
Life threatening complications of empiric ceftriaxone therapy for „seronegative Lyme disease“.
South Med. J. 84 (1991) 1263-65
Nadelman RB Luger SW Frank E Wisniewski M Collins JJ Wormser GP
COMPARISON OF CEFUROXIME AXETIL AND DOXYCYCLINE IN THE TREATMENT OF EARLY LYME DISEASE.
Ann Intern Med 1992 Aug 15;117(4):273-80
Petersen LR Sweeney AH Checko PJ Magnarelli LA Mshar PA Gunn RA Hadler JL
EPIDEMIOLOGICAL AND CLINICAL FEATURES OF 1,149 PERSONS WITH LYME DISEASE IDENTIFIED BY LABORATORY-BASED SURVEILLANCE IN CONNECTICUT.
Yale J Biol Med 1989 May-Jun; 62(3):253-62
Pfister HW; Preac Mursic V; Wils ke B; Schielke E; Sorgel F; Einhäupl KM
Randomized comparison of ceftriaxone and cefotaxime in Lyme neuroborreliosis.
J Infect Dis, (1991 Feb) 163 (2) 311 8
Pfister HW; Preac Mursic V; Wilske B; Einhäupl KM
Cefotaxime vs penicillin G for acute neurologic manifestations in Lyme borreliosis. A prospective randomized study.
Arch Neurol, (1989 Nov) 46 (11) 1190 4
Preac-Mursic V, Wilske B, Schierz G, Holmburger M, Suss E:
In vitro and in vivo susceptibility of Borrelia burgdorferi.
Eur. J. Clin. Microbiol. 6(4) (1987) 424-6
Preac-Mursic V, Weber K, Pfister HW, Wilske B, Gross B, Baumann A, Prokop J:
Survival of Borrelia burgdorferi in antibiotically treated Patients with Lyme Borreliosis.
Infection 17 (1989) 355-359
Preac-Mursic V, Marget W, Busch U, Pleterski Rigler D, Hagl S:
Kill Kinetics of Borrelia burgdorferi and Bacterial Findings in Relation to the Treatment of Lyme Borreliosis.
Infection 24 (1996) 9-16
Riccabona M Kerbl R Schwinger W Spork D Millner M Grubbauer HM
Ceftriaxon-induzierte Cholezystolithiasis- harmlose Nebenwirkung?
Klin Pädiatr 1993 Nov-Dec;205(6):421-3
Skoldenberg-B; Stiernstedt-G; Karlsson-M; Wretlind-B; Svenungsson-B Treatment of Lyme borreliosis with emphasis on neurological disease. Ann-N-Y-Acad-Sci. 1988; 539: 317-23
Steere AC, Hutchinson GJ, Rahn DW, Sigal LH, Craft JE, De Sanna ET, Malawista EE
Treatment of the early manifestations of Lyme disease.
Ann. Intern. Med. 99 (1983b) 22-26
Steere-AC; Levin-RE; Molloy-PJ; Kalish-RA; Abraham-JH-3rd; Liu-NY; Schmid-CH
Treatment of Lyme arthritis.
Arthritis-Rheum. 1994 Jun; 37(6): 878-88
Strle F, Preac-Mursic V, Cimperman J, Ruzic E, Maraspin V, Jereb M:
Azithromycin versus doxycycline for treatment of erythema migrans: clinical and microbiological findings.
Infection 21(2) (1993) 83-8
van Dam AP Kuiper H Vos K Widjojokusumo A de Jongh BM Spanjaard L Ramselaar AC Kramer MD Dankert J
DIFFERENT GENOSPECIES OF BORRELIA BURGDORFERI ARE ASSOCIATED WITH DISTINCT CLINICAL MANIFESTATIONS OF LYME BORRELIOSIS.
Clin Infect Dis 1993 Oct;17(4):708-17
Wahlberg-P; Granlund-H; Nyman-D; Panelius-J; Seppala-I
Treatment of late Lyme borreliosis. J-Infect. 1994 Nov; 29(3): 255-61